炎症は、有害な刺激(ストレス)から身体を守る生体防御反応(適応反応)で、生体恒常性維持に必要なシステムです。加えて、組織修復のための反応ともいえます。これまで炎症は、急性炎症と慢性炎症に分類されてきましたが、慢性炎症は単なる急性炎症の延長ではなく、明らかに質的に異なる反応と考えられています。急性炎症は、本質的に生体を保護するための適応反応であり、一方で「収まらない炎症反応(くすぶり型炎症(炭火型炎症)」である慢性炎症は、「組織リモデリング」が誘導される不可逆的反応といえます。
さらに炎症は、外的因子によってもたらされると思われてきましたが、最近は、内的因子である代謝産物の異常蓄積、高血糖・肥満、壊死細胞から放出される核酸やサイトカイン様の生理活性物質によっても惹起されることが分かってきました。病原体によって炎症を誘導する物質を病原体関連分子パターン(PAMPs ; Pathogen-associated molecular patterns)と内的刺激物質をダメージ関連分子パターン(DAMPs ; Damage-associated molecular patterns)と区別しています。また、内因性因子による非感染性炎症は「自然炎症」ともいわれ、インフラマソームの異常による「自己炎症症候群」という新たな疾患概念も生まれました。インフラマソーム異常は、動脈硬化や心不全、2型糖尿病など多くの生活習慣病やがんなどの発症にも関わっています。さまざまな慢性疾患が誘導する炎症反応に関係する分子、シグナル伝達系、細胞および発症プロセスにはある程度の共通性はあるものの、必ずしも同じではなく不明な点もまだ多くあります。古くて新しい炎症および慢性炎症性疾患発症機序の解明は、緊急性の高い課題といえます。感染における微生物間相互作用や免細胞ネットワークが解明されるにしたがって、生体内で起こる生理現象を全体論(holism)的視点で理解することの必要性が認識されてきています。
さて、感染性慢性炎症性疾患である歯周病の発症機序と全身への影響を考えるにあたり、歯周病原因菌が大量に産生するエピジェネティック制御作用をもつ代謝産物・酪酸を軸に研究が進んでいます。新たな視点から、高濃度酪酸の全身に及ぼす有害作用(為害作用)について、歯周病と全身疾患において考えてみましょう。
1.歯周病と歯周病原細菌
口腔内フローラの16rRNA解析によると、プラーク内を中心に約1,200種類もの細菌が棲息しています。そのうち菌名が分かっているものは約24%、培養されているものの菌名が分からないものが約8%、残りの約68%は未だに培養さえできていないようです。歯周病は感染性慢性炎症性疾患で、我が国の成人約80%が罹患する国民病ともいえます。歯周病原因菌群の中で〝Red Complex〟と呼ばれるポルフィロモナス・ジンジバリス(Porphyromonas gingivalis)、タネレラ・フォーサイシア(Tannerella forsythensis)、トレポネーマ・デンティコラ(Treponema denticola)は特に発症と関係が深いとされています。これら原因菌の主な病原因子として、LPS(リポポリサッカライド)、莢膜、付着線毛、タンパク質分解酵素などが挙げられますが、いずれも一般の病原細菌と比較して、その病原性や炎症誘導能は弱いようです。歯周病の発症機序を細菌にのみ求めるのは困難で、生体の免疫応答、生活習慣、遺伝的素因も深く関与していることから「多因子疾患」といえます。歯周病は、様々な全身疾患の誘因となることが知られています。
嫌気性細菌が大量に産生する代謝産物・短鎖脂肪酸(SCFA ; Short-chain fatty acid)、特に高濃度の酪酸が、歯周組織細胞に強い酸化ストレスを誘導するばかりでなく、全身にも様々な影響を及ぼしています。免疫担当細胞(T細胞、B細胞、マクロファージなど)にこれらの細菌の培養上清液は、アポトーシスやネクローシスを誘導します。プロピオン酸やイソ吉草酸にもこれらの作用は認めますが、高濃度(5mM以上)酪酸でその作用が最も強く認められます。菌種別のSCFA産生性は、P.gingivalis(酪酸、イソ吉草酸)、P.loesheii(酪酸、プロピオン酸、イソ吉草酸)、F.nucleatum(酪酸)でした。歯周病罹患患者の治療前後の歯肉溝内SCFA量が測定された結果、発症時には酪酸とイソ吉草酸濃度が増加し、治療後には顕著に低下していることから、SCFAは病態を反映していると思われます。この功罪を兼ね備えた酪酸のユニークな性状は、がん細胞研究分野から〝酪酸パラドックス(butyrate paradox)〟として興味深く報告されています。腸管では有益で、口腔における高濃度酪酸(5mM以上)は、全身に対して有害作用を示す。このparadoxは、酪酸の作用を、腸管と口腔を比較検討すると理解しやすいと考えられます。
2.酪酸パラドックス(Butyrate paradox)
短鎖脂肪酸(SCFA)は、直鎖のアルキル基を有するモノカルボン酸で、炭素数6未満の脂肪酸で、C₁ギ酸、C₂酢酸、C₃プロピオン酸、C₄イソ酪酸、C₄酪酸(ブタン酸)、C₅イソ吉草酸、C₅吉草酸(ペンタン酸)、C₅2-メチル酪酸を指します。炭素数4以上では構造異性体を生じるため、同じ炭素数で複数の脂肪酸が存在します。炭素数6のカプロン酸などもSCFAに含める場合があります。一方、炭素数1のギ酸は含めない場合もあります。C₂酢酸、C₃プロピオン酸、C₄酪酸が主に相当します。微生物代謝産物・外因性SCFA(exogenus SCFA)と、細胞内代謝産物・内因性SCFA(endogenus SCFA)に分類されます。各種嫌気性菌、ビフィズス菌(Bifidobacteria)、レンサ球菌(Streptococci)、真正細菌(Eubacteria)、ラクトバチルス(Lactobachilli)が多数棲息する腸管内では、様々な有益作用を担っています。口腔内においても歯肉溝内の嫌気性菌がSCFAを産生し、抗菌作用、粘膜上皮細胞発育促進など有益作用が知られています。しかしSCFAの中で酪酸は、濃度によって腸管と口腔では相反作用があります。腸管内において酪酸は、腸管粘膜上皮細胞のエネルギー源となり、また腸管粘膜の免疫応答に有益作用となります。酪酸はヒストン脱アセチル化酵素(HDAC)活性阻害作用(HDACはヒストンタンパク質からアセチル基を除去しクロマチン構造を閉じた状態にしてクロマチン構造の凝集と転写抑制に関与)により、がん抑制遺伝子p21/WAF1の発現を誘導し、大腸がん、その他の腫瘍増殖抑制作用があります。さらに酪酸は、制御性T細胞(Treg)やIL-10産生T細胞の活性化と、NF-KB産生抑制による抗炎症作用などに関わっています。一方、口腔内において1~5mM濃度の酪酸(健康歯肉溝内では通常約2mM)は、種々の細胞において細胞周期抑制作用、アポトーシス、ネクローシス誘導などの為害作用を示します。さらに、HDACのエピジェネティック作用により、潜伏感染のHIVやEB(Epstein-Barr)ウイルスを再活性化することがあります。このように酪酸は、作用する部位と濃度の違いによって、有益・為害作用の両者を持ち合わせた二律背反作用をもつ極めて興味ある物質です。
さて、口腔と腸管での作用の違いは、何に由来しているのでしょうか? 腸管や口腔粘膜はムチン層で被われていて上皮細胞を保護するとともに低分子物質透過性の選択的バリアーとして重要な作用を担っています。このバリアー機能が障害されて引き起こされる疾患が、リーキーガット症候群(腸漏れ症候群、腸管壁侵漏症候群とも呼ばれる)で、腸粘膜の壁にできた小さな隙間や孔(細胞と細胞とを繋いでいる繋ぎ目であるタイト・ジャンクションの隙間)から「炎症誘発物質」が血液中に流入します。そうして身体の免疫システムバランスを崩し、様々な病気の原因になることが分かってきています。重層扁平上皮からなる口腔粘膜の表面は、主に唾液由来の約70㎛程度の薄いムチンの膜で被われています。一方、単層円柱上皮からなる腸管粘膜は〝タイト・ムチン(tight mucin)〟とも呼ばれる粘膜上皮と結合した約150~400㎛の凝固な内層と約800~900㎛の外層からなる極めて厚いムチン層で被われています。したがって、口腔内では高濃度の酪酸が粘膜細胞に直接接触しているが、腸管では高濃度の酪酸が厚いムチン層で保護されているため、粘膜細胞に直接接触する機会はないのではないかと考えられます。
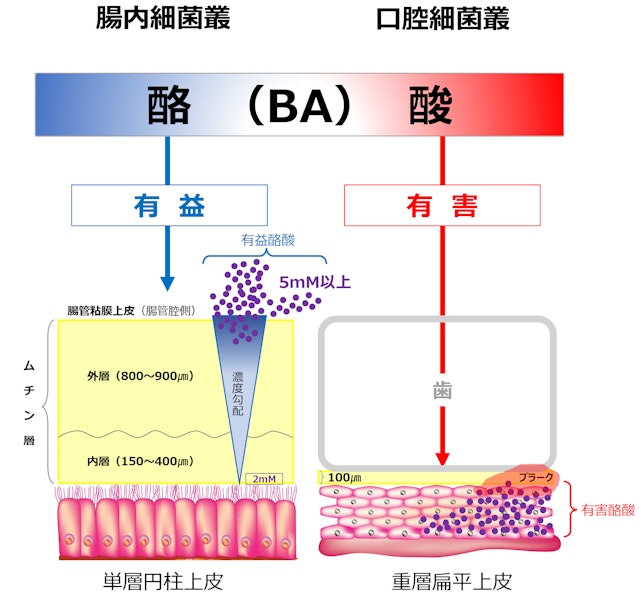
歯肉溝内に産生される酪酸濃度は、健康歯肉溝内では通常2mM程度ですが、重症の歯周病では約12~16mM程度にまで上昇します。健康な歯肉粘膜上皮は、酪酸に対して抵抗性が強いため容易に為害作用は受けません。低濃度の酪酸(1~2mM)では、腸管粘膜同様、発育が促進され有益作用となります。しかし、歯周病菌の産生するタンパク分解酵素やLPSなどにより炎症が誘導され、組織破壊が起こると、酪酸は容易に組織内浸潤し、濃度が上昇します。さらに、粘膜組織の構造上、酪酸は急激に希釈されることなく、組織内に停滞します。炎症や組織破壊を誘導する酪酸濃度(PDL-BA ; peridontal disease level-butyric acid)は、約5mM程度と思われます。

一方、大腸管腔内に産生された高濃度酪酸は、濃度勾配が形成されて、粘膜上皮に接触する際には発育至適濃度(約2mM)に希釈されていると思われます。粘膜内に浸潤した酪酸は、粘膜直下に網の目のように張り巡らされた血管内の血流により一気に稀釈され肝臓で分解されます。したがって、腸管粘膜組織内に酪酸が長時間停滞することはありません。
しかし、過剰・高濃度になると状況は一変し、腸管粘膜組織内にも停滞し、肝臓での分解量を超えると、全身に酪酸が伝播し障害をきたします。人工下痢を起こさせ、ムチン除去後に酪酸を注入すると、腸管粘膜上皮に著しい剥離と強い炎症が誘導されます。これらのことから、口腔と腸管における酪酸の作用の相違は、主に、ムチン層と相互の組織構造の違いに由来するものと考えられます。
3.酪酸に誘導される酸化ストレスと疾患
1)全身への影響
歯周組織に浸潤した酪酸の挙動を検討してみましょう。腸管と異なり、歯周組織の酪酸は長時間停滞し、細胞に対して様々な影響を及ばします。高濃度酪酸は、細胞のミトコンドリアと細胞質内の過酸水素濃度やカタラーゼ活性が上昇し、酸化ストレス誘導が起こされます。
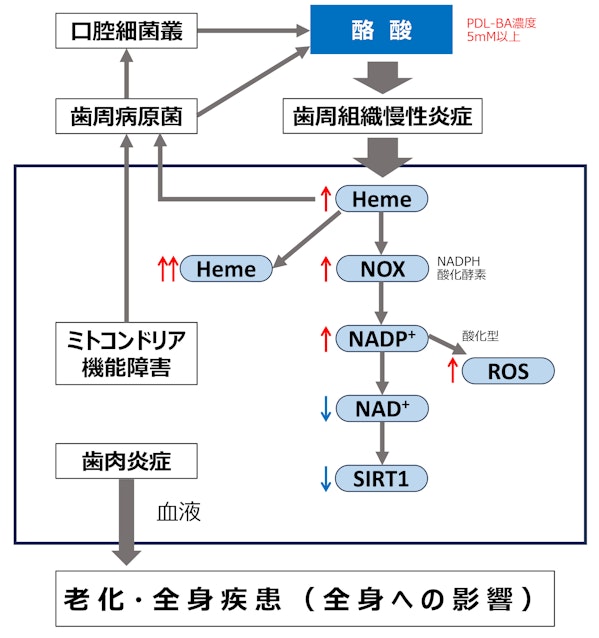
へム(heme)量が増加し、NADPHオキシダーゼ(NOX)のサブユニットであるgi91phox活性とNADPH(ニコチンアミドアデニンジヌクレオチドリン酸)レベルの増加からも過酸水素(H2O2)産生が促進されます。また、細胞質内のNAD⁺(エネルギー通貨)レベルを著しく低下させることから、酪酸は組織内に停滞し細胞毒性を示します。NAD⁺低下に伴いSIRT1レベルも低下します。SIRT1は、血管内皮細胞の酸化ストレスに対して抵抗性を示し、血管内皮細胞老化を抑制します。よって、歯周病組織内における酪酸濃度の上昇と組織内停滞は、歯周局所ばかりでなく長期にわたり全身的に強度の酸化ストレスを誘導し、様々な細胞や組織に為害作用を及ばします。歯周病による全身疾患発症には、歯周局所から持続的に供給される炎症性サイトカインがリスク因子となりますが、歯周病菌が産生する高濃度酪酸も同様にリスク因子となります。
2)細胞への影響
ミトコンドリアは、酸化的リン酸化により、ATP産性の80~90%を担い、細胞内エネルギー通貨として働き、その代謝の中で、hemeの合成、細胞内Ca2+濃度調整やステロイド合成など多岐にわたる代謝に関与しています。さらにミトコンドリアは、生命維持に必要なエネルギー源として様々な細胞内シグナルに関与している活性酸素(ROS)の産生にも深く関与しています。過剰なROS蓄積は様々な細胞障害を起こします。それに伴いミトコンドリア機能障害は、老化、糖尿病、がん、心不全、神経変性疾患などに関わっています。しかし、ミトコンドリア異常により疾患が発症するという従来の視点ではなく、慢性歯周病巣から持続的に酪酸が供給され、歯周病組織細胞や様々な組織内のミトコンドリアがダメージを受け、種々の疾患が発症する、というシナリオです。
hemeもROSと同様に酸化促進と抗酸化という双方向性作用を持っています。hemeは、細胞内ROS産生に関係するNOX subuuit gp91 phoxとカタラーゼに結合します。PDL-BA(炎症と組織破壊誘導酪酸濃度)はheme産生を促進し、歯周組織細胞のミトコンドリア機能障害を誘導し、酸化ストレスネットワークに影響を与えます。酪酸によるミトコンドリアの酸化ストレスはheme量の増加につながるばかりでなくミトコンドリア機能障害はheme合成に影響を及ぼします。
hemeは、代表的歯周病原菌P.gingivalisの必須発育因子です。P.gは、PDL-BAにより誘導される炎症により増加したHemeを利用して、増殖が促進されます。初期のミトコンドリアの酸化ストレス障害は、Heme産生増加によるP.gの増加を促進し、その結果として産生される酪酸量が増加します。さらにミトコンドリア機能障害が誘導され、酸化ストレス障害により生体防御反応の低下を惹起する。負のスパイラルが形成されます。
4.ヘム分解における酸素活性化~活性酸素の有効利用
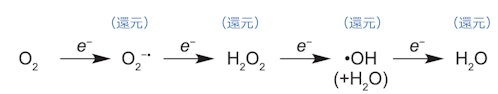
酸素(O2)は生物にとって諸刃の剣です。好気呼吸は大きなエネルギーを産み出し、また、O₂を用いる酸化反応は様々な物質の産生・薬物代謝を担っています。しかし一方、酵素などによるO₂の還元過程では活性酸素(ROS)が生成する危険が常につきまといます(図1)。このため、生物は幾重にも抗酸化機構を備えるとともに、酵素反応からのROS産生も抑制する必要があります。生体酸化の中心プレーヤーの1つは、活性中心にヘム(鉄-ポルフィリン錯体)をもつヘムタンパク質です。ヘム関連酵素の中でも異色の反応を触媒するヘム分解酵素(ヘムオキシゲナーゼ ; HO)に注目したいと思います。
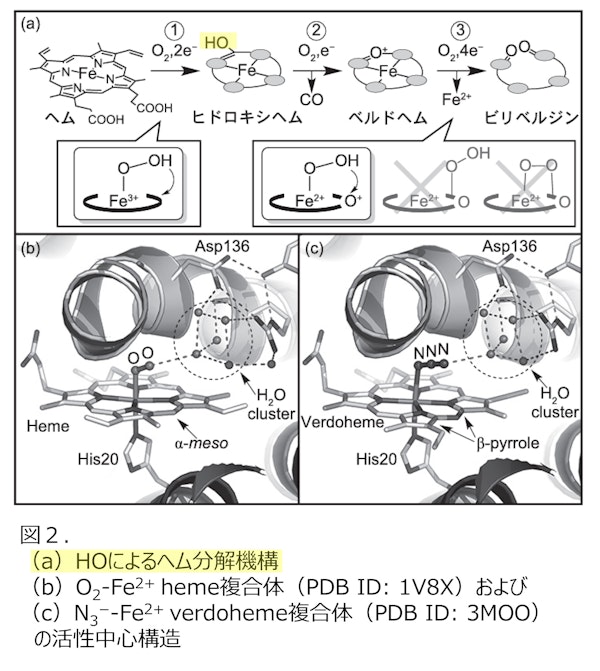
HOは、ヘムを鉄(Fe)、一酸化炭素(CO)、ビリベルジンに分解鶴酵素です。ヘム代謝のみならず、鉄の恒常性維持、シグナル伝達抗酸化作用、酸素センシングなどの重要な生理機能を担っています。HOは3段階の酸素添加反応により進行しますが、すべてのO₂活性化を基質自身が行う自己分解の点が、他の酵素には見られない特色です。
酪酸に誘導される、細胞質内の酸化ストレスは、NADP⁺(酸化型)増加と、NAD⁺の低下により、NOX活性、特にヘム依存性のNOX2の活性とその増加は、ERストレスによるアポトーシスを誘導し、ミトコンドリア機能障害につながる(図3)。そうして、加齢化と全身性疾患発症に関係してきます。
口腔に常在する歯周病菌が、加齢や様々な影響により、微生物叢の遷移が誘導され病原菌が増殖し、病原性を発揮します。その際に産生される酪酸により細胞レベルにおいて持続的酸化ストレスが起こり、慢性炎症や破壊が誘導されて歯周病が発生します。その結果、様々な全身疾患の誘因となるばかりではなく、そのエピジェネティック制御作用により、潜伏感染ウイルス再活性化、がん化など新たな疾患の発症へとつながっていくのです。
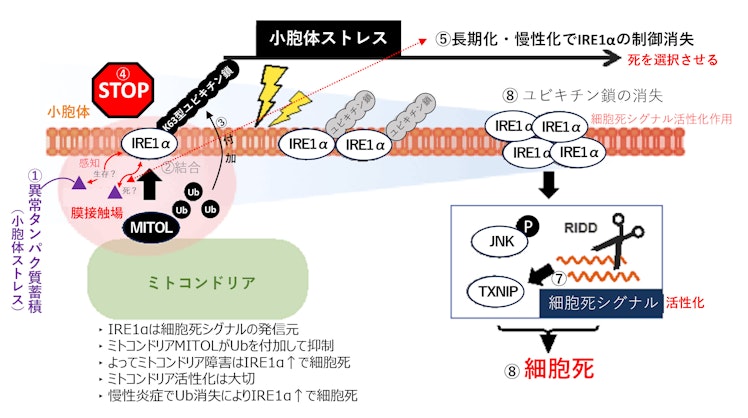
5.小胞体(ER)ストレスにおける小胞体IRE1αとミトコンドリアMITOL
小胞体に局在する分子IRE1αが異常タンパク質蓄積を感知して、細胞生存or細胞死を誘導するスイッチ機構が明らかとなりました。ミトコンドリアと小胞体の接着部位において、ミトコンドリアに局在する分子MITOLが小胞体上のIRE1αにユビキチン鎖付加をして細胞死抑制の制御をしています。
小胞体IRE1αは、細胞死シグナルの発信元で、①小胞体(ER)ストレス(異常タンパク質蓄積)が起こると、それを感知して細胞を生存させるのか? アポトーシスさせるか? を決めなければなりません。細胞死しすぎると生体は困るので、②ミトコンドリアMITOLは膜接触場を足場にしてIRE1αと結合し、③細胞死スイッチを抑制するユビキチン鎖シグナルを付加します。④そのため小胞体が急なストレス状態に転じても細胞死は起こりません。しかし、⑤ストレスが慢性化(慢性炎症)すると、⑥MITOLによるIRE1αの抑制が外れてユビキチン鎖が消失し、⑦IRE1αの細胞死シグナルが活性化するため、⑧細胞死へと移行します。
<引用・参考文献>
『腸内細菌・口腔細菌と全身疾患<普及版>』(落合邦康 監修 シーエムシー出版)
『生物物理51巻3号』(日本生物物理学会)
